Een recente studie richtte zich op het gebruik ervan voor celtherapie, een nieuw type behandeling voor kanker. Er werd aangetoond dat de celsorteer-chip in staat is om T-celpopulaties te sorteren met behoud van levensvatbaarheid en potentie. Door het toevoegen van ‘cel focusing’ technologie en optische golfgeleiders evolueert het ontwerp in de richting van een echt multi-marker multichannel platform. Zo’n platform maakt een meer nauwkeurige en snelle celsortering mogelijk voor celtherapietoepassingen waardoor die op hun beurt veiliger en effectiever zouden worden.
Liesbet Lagae, programmadirecteur Life Science Technologies bij imec, en collega Sarah Libbrecht, senior bio-application specialist bij imec, geven tekst en uitleg bij de nieuwe resultaten die werden geboekt met de celsorteer-chip.
Hoe werkt de celsorteer-chip?
In 2014 startten Liesbet Lagae en haar collega's (in het kader van een prestigieus ERC-project (SCALPEL)) met de ontwikkeling van imecs celsorteer-chip. Liesbet Lagae: "Deze chip van slechts enkele cm² kan specifieke cellen uit bv. een bloedstaal isoleren. Dit door individuele cellen doorheen een microfluïdisch kanaal te duwen en te sorteren volgens een principe dat ook inkjetprintkoppen gebruiken. In cijfers: de chip kan 5.000 cellen/sec. per microfluïdisch kanaal sorteren, met een sorteeropbrengst van meer dan 90% van de cellen, met een zuiverheid tot 99% en met behoud van de levensvatbaarheid van de cellen. De uitgang van de cell sorter is compatibel met single-cel sequencing workflows waardoor de chip in de toekomst een onmisbaar instrument zou kunnen worden voor kankerdiagnose, voor de opvolging van de behandeling en om de effectiviteit van de nieuwe en zeer dure immuuntherapieën te controleren.
Deze video beschrijft het unieke werkingsmechanisme van de celsorteer-chip die micro-gasbellen (gecreëerd door micro-verwarmingselementen) gebruikt om een jetflow te genereren. Zo verkrijg je een ‘zachte’ maar snelle celsortering in een microfluïdisch kanaal.
Kan de celsorteer-chip de therapeutische effectiviteit van CAR-T celtherapie verbeteren en het naar de klinische praktijk brengen?
In 2018 startte Liesbet Lagae, als gevolg van eerste inzichten en resultaten uit het SCALPEL-project, met een tweede project (JetCell), eveneens gefinancierd door ERC. In dit tweede project was het de bedoeling om na te gaan of dezelfde technologie kan worden gebruikt om celtherapie te verbeteren. Liesbet kreeg hierbij de hulp van collega Sarah Libbrecht,
Celtherapie is een van de meest veelbelovende nieuwe kankerbehandelingen. Met name CAR-T celtherapieën worden steeds populairder. Het is gebaseerd op het eigen immuunsysteem van de patiënt (T-cellen) dat wordt gestimuleerd om kanker te bestrijden. Regelmatig komen er nieuwe klinisch goedgekeurde therapieën op de markt en er werden reeds honderden start-ups gelanceerd op het gebied van celtherapie. Vorige maand voorspelde GrandView Research een meer dan verdubbeling van de wereldwijde markt voor kankerimmunotherapie, van 58,1 miljard dollar in 2018 tot 126,9 miljard dollar in 2026 (bron: GEN).
Liesbet Lagae: "In een typische celtherapie-workflow worden relevante T-cellen geïsoleerd uit het bloed van de patiënt, vervolgens aangepast om bepaalde kankermerkers te herkennen, en terug ingebracht in lichaam van de patiënt, waar de gemanipuleerde T-cellen het immuunsysteem aanzetten om de kwaadaardige tumorcellen aan te vallen en uiteindelijk te elimineren".

Een typische celtherapie-procesflow.
Van R&D naar klinische toepassing. In verschillende stappen van de procesflow (isolatie van cellen van de patient, celmodificatie, celexpansie, kwaliteitscontrole) moeten therapeutische T-cellen worden geselecteerd uit een pool van cellen en andere bestanddelen. Huidige technieken omvatten ‘fluorescence activated cell sorting’ (FACS) en ‘magnetic (bead-based) cell sorting’ (MACS).
Liesbet Lagae: "Uit onze gesprekken met de ontwikkelaars van celtherapieproducten hebben we geleerd dat zij over het algemeen tevreden zijn over de flexibiliteit en de prestaties van MACS en FACS als celscheidingsinstrument voor O&O-toepassingen. Echter, eens celtherapie breder zal worden toegepast in de klinische praktijk, zien deze experten wel problemen opduiken bij het gebruik van deze technieken. Dit vanwege het complexe werkingsmechanisme, het gebrek aan automatisering, het risico van besmetting en overdracht (als gevolg van het ontstaan van aerosol) en de tijdsdruk in de logistiek, de staal- en toestelvoorbereiding. Kortom, deze onderzoeksinstrumenten zijn niet compatibel met de Good Manufacturing Practices (GMP) die de basis vormen van elke farmaceutische productiestroom.
High-throughput systeem. Om commercieel levensvatbaar te worden en ervoor te zorgen dat de patiënt binnen een redelijke termijn behandeld wordt, is het belangrijk dat de gebruikte cel-sorteertechniek niet alleen zeer nauwkeurig is, maar ook een zeer hoge doorvoersnelheid heeft. Liesbet Lagae: "Onze microfluïdische chip is gebaseerd op halfgeleidertechnologie, de kampioen in integratie en massaproductie. De kleine structuren van een individuele celsorteerder kunnen in honderdduizenden exemplaren worden geproduceerd op één geïntegreerde chip. Ze kunnen dan allemaal in parallel werken om een batch snel op te zuiveren".
Precisie is de sleutel. Daarnaast vereist de productie van celtherapie een zeer nauwkeurige celsorteer-tool die cellen selecteert op basis van meerdere merkers. Vandaag de dag is de doeltreffendheid van de therapie niet altijd hoog, zelfs niet voor goedgekeurde batches (waarvoor veel handmatige tests nodig zijn). Dit komt waarschijnlijk doordat de cellen heterogener zijn dan oorspronkelijk gedacht. Liesbet Lagae: "Huidige magnetic bead-gebaseerde testen werken niet op basis van individuele cellen en zijn niet gemakkelijk aan te passen tot multi-merker testen. Met onze celsorteer-techniek kan elke individuele cel in een batch gescreend en gesorteerd worden, en kunnen meerdere merkers gebruikt worden voor dit selectieproces. De technologie kan zelfs onderscheid maken tussen hoge en lage expressieniveaus van membraaneiwitten/merkers".
GMP in een doos. De relatief grote afmetingen en de hoge kosten van de huidige tools zijn niet bevorderlijk voor het gebruik ervan in een gedecentraliseerde setting. Het concept van GMP-in-a-box, waarbij het hele proces van celproductie wordt geïmplementeerd in een ‘gesloten doos’ systeem, vereist immers dat de kritische componenten uiterst klein en kostenefficiënt zijn.
Ook verwijzen FDA- en GMP-richtlijnen naar gesloten systemen voor celtherapie om de veiligheid van de patiënten te waarborgen. Een gesloten, geautomatiseerd systeem met een cartridge die wegwerpbaar is (één voor elke patiënt) en geen manuele handelingen vereist, is de ultieme droom van de celtherapiegemeenschap. De ontwikkeling van dergelijke systemen zijn van cruciaal belang voor het succes van autologe therapieën (zoals de CAR-T celtherapie voor kanker) in de toekomst. Liesbet Lagae: "Met microfluïdische chips zoals onze celsorteer-chip komen dergelijke scenario's binnen handbereik. Natuurlijk zou dit een volledige systeemontwikkeling vereisen: een microfluïdische chip, hardware en software voor instrumenten".
Microfluïdische 'jet'-celsortering van T-cellen aantonen
Een eerste belangrijke vraag die in het Jetcell-project gesteld werd, was of de celsorteer-technologie geschikt is voor het selecteren van T-cellen.
Sarah Libbrecht: "Er zijn twee dingen die essentieel zijn voor de productie van T-cellen: zuiverheid en levensvatbaarheid. Als proof of concept wilden we de T-helpercellen, geïdentificeerd als CD4+ en CD14-, zuiveren. In de standaardpraktijk wordt deze celpopulatie geïsoleerd met behulp van magnetische bolletjes waaraan antilichamen zijn bevestigd, vaak in een tweefasige isolatieprocedure. Met behulp van de cell sorter, kan deze isolatie worden uitgevoerd in een enkele stap met behulp van fluorescent-gelabelde antilichamen."
"We verkregen een zuiverheid van 86%. Bovendien kunnen we de selectiecriteria nog verder optimaliseren om een hogere zuiverheid te bekomen en zo aan de eisen van de klinische productie te voldoen."
"Om de levensvatbaarheid van de gesorteerde cellen te beoordelen, hebben we de groei en expansie gecontroleerd volgens de standaard productieprocedures. Zoals verwacht, resulteert onze ‘zachte’ methode van celsortering in levensvatbare cellen die in staat zijn om te groeien en te delen, op een gelijkaardige manier als geïsoleerde MACS-cellen."

Groeicurve (links) van T-helpercellen na isolatie-op-chip ten opzichte van de standaard isolatie met behulp van magnetische bolletjes. De geïsoleerde T-cellen zijn gezond en interageren met de dynabead expansiekorrels (rechts).
Het ‘high-throughput’ potentieel aantonen voor T-celselectie
Tools voor het sorteren van CAR T-cellen vereisen een zeer hoge doorvoercapaciteit voor het sorteren van cellen, tot een miljard cellen. Dit is een grote uitdaging als je maar één kanaal gebruikt omdat de cellen beschadigd raken bij een te hoge stroomsnelheid. Daarom is het interessanter om de doorvoercapaciteit te verhogen door meerdere kanalen in parallel te gebruiken. Dit is vooral haalbaar met microfluïdische celsortering vanwege de inherente schaalbaarheid van de technologie. Dit is meteen ook het grote technologische voordeel van imecs chipsorteer-techniek ten opzichte van andere concurrerende technologieën zoals commerciële FACS en MACS.
Sarah Libbrecht: “In een eerste ontwerp gebruikten we voor elk sorteerkanaal onafhankelijke in- en outletgaten en verbindingskanalen om ervoor te zorgen dat de cellen ‘gefocust’ worden op de detectieplaats dankzij hydrodynamische krachten. Dit zal echter te complex en te ruimteverslindend zijn wanneer honderden tot duizenden kanalen worden gebruikt. Op basis van dit proof-of-concept konden we aantonen dat akoestische celfocus een veelbelovende aanpak kan zijn wanneer tientallen, honderden of zelfs duizenden kanalen in parallel gebruikt worden. Vergeleken met andere focustechnieken is acoustophorese een relatief goedkope maar effectieve methode. Bovendien is acoustophorese biologisch vriendelijk en zacht voor cellen.”
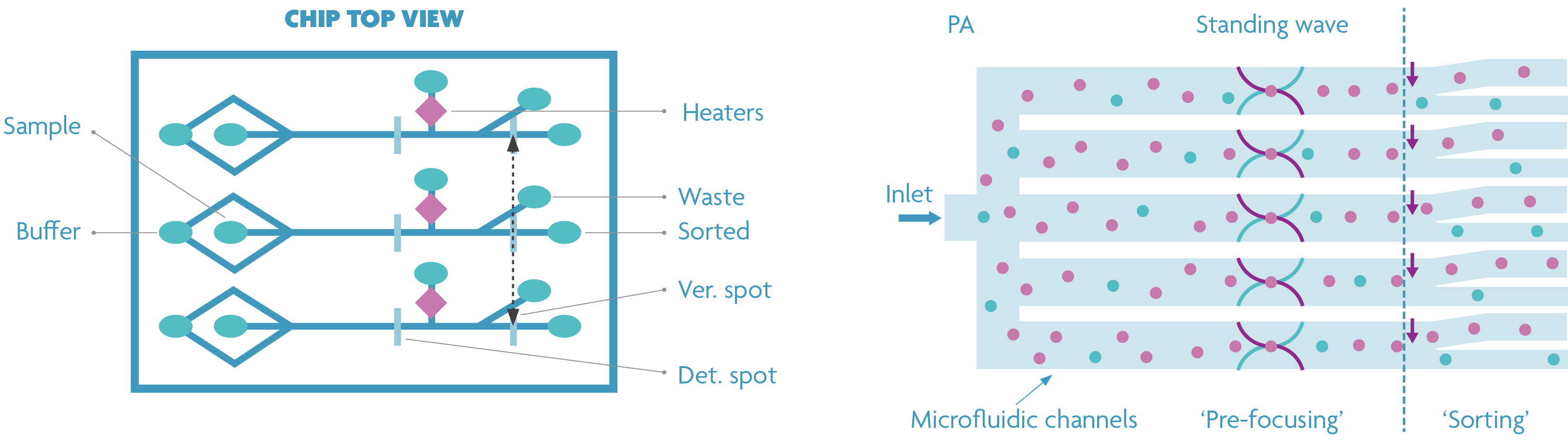
Standaard (links) en geoptimaliseerd (rechts) ontwerp dat het potentieel van de celsorteerder voor parallellisatie aantoont. In het geoptimaliseerde ontwerp wordt akoestische celfocusing gebruikt door een piezoelektrisch materiaal aan te brengen op de achterkant van de chip.
Sarah Libbrecht: "De resultaten toonden aan dat de akoestische focus geen invloed had op de werking van de gasbellen (bv. het ontstaan en afbreken van micro-gasbellen) voor de sortering en vice versa. We zullen dit principe verder verbeteren en integreren met de celsortering om een echt schaalbaar meerkanaals-sorteerplatform te creëren.”
Het hoge precisie (=multi-merker) potentieel van de cell sorter aantonen
Multi-merker detectie is de sleutel tot het veiliger en effectiever maken van celtherapie. Het maakt het systeem vrij complex doordat meerdere kanalen en merkers gebruikt worden. Om meerdere merkers te kunnen detecteren, moeten meerdere golflengtes individueel optisch uitgelijnd en gedetecteerd kunnen worden en moeten realtime beslissingen kunnen gemaakt worden om de celsorteerder te sturen.
Sarah Libbrecht: "We zijn deze uitdaging aan het aanpakken door gebruik te maken van fotonische golfgeleiders op de chip die de gewenste golflengten verdelen over de microfluïdische kanalen voor de detectie van verschillende fluorescerende merkers. We bouwden een optisch model dat rekening houdt met de microfluïdische kanalen, de golfgeleiderexcitatie-optiek, de optische collectie-optiek en de commerciële detectoren. Op basis van uitgebreide simulaties hebben we een architectuur afgeleid van celsorteerkanalen met geïntegreerde golfgeleiders voor multimerker / kleurdetectie."

Initieel concept van multimerker/kleur celsorteerkanalen (4 golfgeleiders = 4 merkers kunnen gelijktijdig gedetecteerd worden). De 4 excitatiegolflengtes kunnen afkomstig zijn van één laser of van meerdere lasers.
Conclusie & toekomstig werk
Deze resultaten zijn veelbelovend en er werden innovatieve optimalisaties uitgewerkt voor het celsorteer-platform. Verdere tests en ontwikkelingen zijn nodig om al deze functies te integreren tot een echt high-throughput, multi-merker celsorteerplatform. Er is nog een lange weg te gaan om de gedemonstreerde ideeën verder uit te werken. Dit kan alleen worden bereikt door samen te werken met geïnteresseerde partijen binnen bv. de celtherapiewereld en er wordt momenteel hard gewerkt aan een dergelijke samenwerking.
Liesbet Lagae: "De jet-flow cell sorter is opnieuw een mooi voorbeeld van hoe de halfgeleidertechnologie een revolutie kan teweegbrengen in de diagnostische en therapeutische wereld. Dankzij de unieke integratie, parallellisatie en kostefficiente mogelijkheden van de halfgeleidertechnologie en de knowhow van medische bedrijven, kunnen we het leven van veel patiënten in de toekomst veranderen".
Meer weten?
- Op de ERC-website vind je dit mooie verhaal van Liesbet Lagae’s projecten, SCALPEL en Jetcell.
- Wil je graag een whitepaper downloaden die imec schreef over celtherapie? Gebruik dan deze download link.
- Contacteer ons als je de paper “Micro vapor bubble jet flow for safe and high-rate fluorescence-activated cell sorting” graag wil ontvangen.

Liesbet Lagae is mede-oprichter en programmadirecteur van de Life Science Technologies in imec. In deze functie houdt ze toezicht op de nieuwste R&D topics, de door de overheid gefinancierde activiteiten en de oprichting van spinoffs. Ze behaalde een doctoraatsdiploma aan de KU Leuven voor haar werk op Magnetic Random Access Memories. Als jonge groepsleider heeft ze het onderzoek naar moleculaire en cellulaire biochips bij imec opgestart. Het life science programma is uitgegroeid tot een volwaardige businesslijn die slimme siliciumchipoplossingen biedt aan de life science industrie. Toepassingen zijn onder meer: medische diagnostiek, point-of-care oplossingen, DNA-sequentiebepaling, cytometrie, bioreactoren, neuroprobes, implantaten. Ze heeft een prestigieuze ERC-consolidatiebeurs voor het ontwikkelen van een platform voor analyse en sortering van enkelvoudige cellen. Ze is (mede)auteur van meer dan 125 peer-reviewed papers in internationale tijdschriften en heeft 15 patenten. Ze is ook parttime hoogleraar nanobiotechnologie aan de KU Leuven/afdeling Fysica.

Sarah Libbrecht studeerde Biochemie aan de KU Leuven. In 2017 behaalde ze een doctoraat in de biomedische wetenschappen aan de KU Leuven voor haar werk over het ontrafelen van de rol van de anterieure olfactorische kern in de volwassen neurogenese van knaagdieren met behulp van nieuwe neuromodulatietechnieken. In deze studie werkte ze samen met imec aan één van de eerste neuroprobes die stimulatie en registratie van neuronale activiteit combineerde. Na het behalen van haar doctoraatsdiploma ging ze bij imec aan de slag en werkte als senior bio-application specialist mee aan de ontwikkeling van de cell sorter chip voor celtherapietoepassingen.
Gepubliceerd op:
5 oktober 2019












